QUÁ TRÌNH FENTON XỬ LÝ NƯỚC THẢI
QUÁ TRÌNH FENTON XỬ LÝ NƯỚC THẢI
Tư vấn xây dựng hệ thống xử lý nước thải bằng quá trình Fenton.
Sử dụng phản ứng oxy hóa để phá hủy các chất độc hại là một phương pháp xử lý ô nhiễm có hiệu quả. Từ đầu những năm 70 người ta đã đưa ra một quy trình áp dụng nguyên tắc phản ứng Fenton để xử lý ô nhiễm nước thải mà theo đó hyđro peroxyt phản ứng với sắt (II) sunfat sẽ tạo ra gốc tự do hyđroxyl có khả năng phá hủy các chất hữu cơ. Trong một số trường hợp nếu phản ứng xảy ra hoàn toàn, một số chất hữu cơ sẽ chuyển hóa thành CO2 và nước. Hiện nay các quy định bảo vệ môi trường càng trở nên khắt khe hơn vì vậy phương pháp Fenton lại càng được chú trọng.
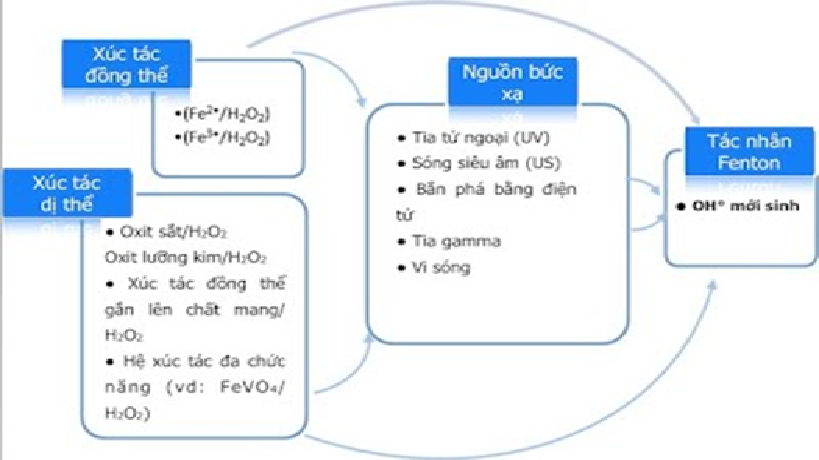
Dùng cho phản ứng Fenton cần có xúc tác và chất oxy hóa. Chất xúc tác có thể là muối sắt hai hoặc sắt ba còn chất oxy hóa là hyđro peroxit. Phản ứng tạo ra gốc tự do hyđroxyl diễn ra như sau:
Fe2+ + H2O2 > Fe3+ + OH- + OH.
Fe3+ + H2O2 -> Fe2+ + H+ + HOO.
2H2O2 > H2O + OH. + HOO.
Phản ứng của gốc hydroxyl :Gốc hydroxyl là chất oxy hóa mạnh, chỉ sau Fluorine. Phản ứng hóa học của gốc hydroxyl trong nước có 4 dạng :
(1) Dạng cộng thêm : Gốc hydroxyl thêm vào một hợp chất chưa bão hòa, aliphatic (béo) hay aromatic (thơm) để tạo nên một sản phẩm có gốc tự do .
*OH + C6H6 -> *(OH)C6H6
(2) Dạng loại hydro : Phản ứng tạo ra một gốc hữu cơ tự do và nước
*OH + CH3OH -> *CH2OH + H2O
(3) Dạng chuyển đổi electron : Tạo ra những ion ở trạng thái hóa trị cao hơn (hoặc một nguyên tử, một gốc tự do nếu ion mang điện tích 1- bị oxy hóa ) :
*OH + [Fe(CN)6]4- -> [Fe(CN)6]3- + OH-
(4) Dạng tương tác giữa các gốc : 2 gốc hydroxyl phản ứng với nhau hay 1 gốc hydroxyl phản ứng với một gốc khác để tạo nên một sản phẩm bền vững hơn:
*OH + *OH -> H2O2
Trong việc ứng dụng phản ứng Fenton xử lý nước thải, những điều kiện của phản ứng được điều chỉnh để ưu tiên xảy ra theo 2 cơ chế đầu.
Ngoài ra, phản ứng oxy hóa còn được xúc tác bởi một lượng nhỏ mangan dưới dạng muối sulfate. Các nghiên cứu trước đây cho thấy, sự hiện diện của mangan làm tăng hiệu quả phản ứng nhưng chỉ với một tỉ lệ mangan rất thấp (nếu nhiều mangan quá cũng không tốt). Mangan làm tăng tác dụng hấp phụ của bông hydroxit và vai trò của mangan chủ yếu thể hiện khi pH được nâng lên khoảng 7-8.
Quá trình Fenton trong xử lý nước thải
Thông thường qui trình oxi hóa Fenton đồng thể gồm 4 giai đoạn:
Điều chỉnh pH phù hợp: Trong các phản ứng Fenton, độ pH ảnh hưởng tới tốc độ phản ứng và nồng độ Fe2+ , từ đó ảnh hưởng lớn đến tốc độ phản ứng và hiệu quả phân hủy các chất hữu cơ, pH thích hợp cho quá trình là từ 2 – 4, tối ưu nhất là ở mức 2. 8. Đã có nhiều công trình nghiên cứu nhằm giảm thiểu khó khăn khi đưa pH về mức thấp rồi sau đó lại nâng pH lên mức trung tính để tách khử Fe, H2O2 dư. Nếu ta dùng các chất xúc tác khác như quặng sắt Goethite (a-FeOOH), cát có chứa sắt, hoặc sắt trên chất mang Fe/SiO2, Fe/TiO2, Fe/than hoạt tính, Fe/Zeolit… thì quá trình này gọi là Fenton dị thể, pH thích hợp ở trường hợp này theo nghiên cứu cao hơn đồng thể, khoảng từ 5 – 9.
Phản ứng oxi hóa: Trong giai đoạn phản ứng oxi hóa xảy ra sự hình thành gốc *OH hoạt tính và phản ứng oxi hóa chất hữu cơ. Cơ chế hình thành gốc *OH hiện nay chưa thống nhất, theo Fenton thì sẻ có phản ứng: Fe2+ + H2O2 —-> Fe3+ + *OH + OH–. Gốc *OH sau khi hình thành sẽ tham gia vào phản ứng ôxi hóa các hợp chất hữu cơ có trong nước cần xử lý, chuyển chất hữu cơ từ dạng cao phân thành các chất hữu cơ có khối lượng phân tử thấp. CHC (cao phân tử) + *HO ——> CHC (thấp phân tử) + CO2 + H2O + OH-
Trung hòa và keo tụ: Sau khi xảy ra quá trình oxi hóa cần nâng pH dung dịch lên >7 để thực hiện kết tủa Fe3+ mới hình thành: Fe3+ + 3OH- —–> Fe(OH)3. Kết tủa Fe(OH)3 mới hình thành sẽ thực hiện các cơ chế keo tụ, đông tụ, hấp phụ một phần các chất hữu cơ chủ yếu là các chất hữu cơ cao phân tử
Quá trình lắng: Các bông keo sau khi hình thành sẽ lắng xuống khiến làm giảm COD, màu, mùi trong nước thải. Sau quá trình lắng các chất hữu cơ còn lại (nếu có) trong nước thải chủ yếu là các hợp chất hữu cơ có khối lượng phân tử thấp sẽ được xử lý bổ sung bằng phương pháp sinh học hoặc bằng các phương pháp khác.
Các yếu tố ảnh hưởng đến phản ứng Fenton :
Ảnh hưởng của nồng độ sắt : Nếu không có sắt, sẽ không có sự hình thành gốc hydroxyl. Chẳng hạn như, H2O2 được thêm vào nước thải có tính phenol (nồng độ phenol không giảm vì phản ứng phá hủy phenol cần xúc tác sắt). Khi nồng độ sắt tăng, sự loại trừ phenol tăng đến điểm mà tại đó, nếu có thêm sắt vào nữa thì hiệu quả cũng không tăng. Khoảng liều lượng tối ưu cho xúc tác sắt thay đổi tùy theo loại nước thải và là đặc trưng của phản ứng Fenton. Liều lượng sắt cũng có thể diễn tả dưới dạng liều lượng H2O2 . Khoảng điển hình là 1 phần Fe trên 1-10 phần H2O2.
Ảnh hưởng của dạng sắt : Đối với hầu hết các ứng dụng, muối Fe2+ hay Fe3+ đều có thể dùng xúc tác phản ứng. Phản ứng bắt đầu xúc tác nhanh chóng nếu H2O2 nhiều. Tuy nhiên, nếu lượng hệ chất Fenton thấp (dưới 10-25 mg/l H2O2), các nghiên cứu cho thấy sắt II được ưa chuộng hơn. Mặt khác, muối sắt chloride hay sulfat đều có thể được sử dụng. Cũng có khả năng tái tuần hoàn sắt sau phản ứng bằng cách tăng pH, tách riêng các bông sắt và tái axit hóa bùn sắt.
Ảnh hưởng của nồng độ H2O2 : Các gốc hydroxyl oxy hóa chất hữu cơ mà không phân biệt. Ví dụ về một chuỗi phản ứng
Chất nền -> A -> B -> C -> D -> CO2
Với A, B, C, D đại diện cho các chất trung gian bị oxy hóa. Mỗi sự chuyển đổi trong chuỗi này có tốc độ phản ứng riêng, và đôi khi chất trung gian tạo ra lại là một chất ô nhiễm không mong đợi. Những chất này đòi hỏi phải đủ lượng H2O2 để đẩy phản ứng lên trên điểm đó. Điều này có thể quan sát được khi tiền xử lý một nước thải hữu cơ phức tạp để giảm tính độc. Khi liều lượng H2O2 bắt đầu tăng dần, sự khử COD có thể xảy ra với ít hoặc không có sự thay đổi độc tính cho đến khi đạt một ngưỡng mà trên ngưỡng đó, việc thêm H2O2 sẽ làm giảm nhanh chóng độc tính nước thải.
Ảnh hưởng của nhiệt độ : Tốc độ phản ứng Fenton tăng cùng với sự gia tăng nhiệt độ, nhất là khi nhiệt độ nhỏ hơn 200C. Tuy nhiên, khi nhiệt độ lớn trên khoảng 40-500C, hiệu suất sử dụng của H2O2 giảm do sự phân hủy H2O2 tăng (tạo thành oxy và nước). Hầu hết các ứng dụng của phản ứng Fenton xảy ra ở nhiệt độ 20-400C. Khi xử lý chất thải ô nhiễm nặng, việc thêm H2O2 phải tiến hành tuần tự có kiểm soát để điều chỉnh sự gia tăng nhiệt độ (nhất là khi lượng H2O2¬ lớn hơn 10-20g/l). Điều hòa nhiệt độ quan trọng còn bởi lý do an toàn.
Ảnh hưởng của pH : pH tối ưu của phản ứng Fenton trong khoảng 3-6 (4-4,5 :tốt). Khi pH tăng cao trên 6, hiệu suất phản ứng sụt giảm do sự chuyển đổi của sắt từ ion sắt II thành dạng keo hydroxit sắt III. Dạng sắt III hydroxide xúc tác phân hủy H2O2 ¬thành oxy và nước mà không tạo nên gốc hydroxyl. Khi pH nhỏ hơn 3, hiệu suất phản ứng cũng sụt giảm nhưng đỡ hơn.
Mặt khác, pH còn liên hệ với tiến triển của phản ứng. Ví dụ như pH nước thải ban đầu là 6. Trước tiên, pH giảm do thêm xúc tác FeSO4 . Sau đó, pH giảm nhiều hơn khi thêm H2O2¬, sự giảm cứ tiếp tục dần dần đến một mức nào đó (tùy vào nồng độ xúc tác). Người ta cho là sự giảm này do quá trình phân hủy các chất hữu cơ thành axit hữu cơ. Sự thay đổi pH thường xuyên được giám sát để đảm bảo rằng phản ứng đang phát triển theo đúng tiến độ. Nếu không xảy ra sự giảm pH, điều đó có thể có nghĩa là phản ứng bị cản trở. Những dòng nước thải đậm đặc (10g/l COD) cần oxy hóa nhiều bậc và điều chỉnh lại pH sau mỗi giai đoạn để ngăn ngừa pH thấp làm cản trở phản ứng.
Ảnh hưởng của thời gian phản ứng : Thời gian cần thiết để hoàn thành một phản ứng Fenton phụ thuộc vào nhiều yếu tố trên, đáng chú ý nhất là liều lượng xúc tác và mức ô








































































































































































